大牌評審專家深入解析保健食品新法研發(fā)申報
2017-04-17

2017年4月8-9日,由中國保健協(xié)會食物營養(yǎng)與安全專業(yè)委員會主辦,北京中健天行醫(yī)藥科技有限公司協(xié)辦的“2017保健食品新法規(guī)研發(fā)申報”專題研討會在京成功舉辦。本次研討會有眾多大牌評審專家出席,深入探討《保健食品注冊與備案管理辦法》及保健食品立項調(diào)研、新品研發(fā)、配方配伍、生產(chǎn)工藝等相關(guān)內(nèi)容。

中國中醫(yī)科學(xué)院中藥研究所,國家食藥監(jiān)總局保健食品審評專家張保獻(xiàn)在會中,以《基于新的保健食品技術(shù)法規(guī)下的生產(chǎn)工藝審評要點》為主題,針對已經(jīng)正式實施的《保健食品注冊與備案管理辦法》中關(guān)于產(chǎn)品的注冊流程、審評流程及研發(fā)報告中生產(chǎn)工藝研究部分做了技術(shù)型解析。
張保獻(xiàn)教授提到,《保健食品注冊與備案管理辦法》于2016年7月1日實施以來,主要分為兩類:注冊制與備案制,相對以往的注冊流程做了顛覆性改變,新的審評流程也由專家審評改為內(nèi)審,原料標(biāo)準(zhǔn)可由企業(yè)研究制定后報省局備案后即可生產(chǎn),進(jìn)行全國銷售。
張保獻(xiàn)教授強(qiáng)調(diào),注冊申請人應(yīng)提供詳細(xì)的功效成分或標(biāo)志性成分檢測方法以及檢測方法的適用性、重現(xiàn)性等方法學(xué)研究材料。營養(yǎng)補(bǔ)充劑和純度在98%以上的原料可不提供生產(chǎn)工藝,對除營養(yǎng)補(bǔ)充劑和純度在98%以上的原料外的原料,應(yīng)提供原料的生產(chǎn)工藝。提取物的生產(chǎn)工藝流程圖要盡量詳細(xì),最好附有工藝說明,注意用酶的種類、注意加工助劑的許可使用與否、注意所用技術(shù)有無特殊要求、 注意提取率(出膏率) 、水解應(yīng)說明酸的種類。

中國中醫(yī)科學(xué)院首席研究員,國家食藥監(jiān)總局保健食品審評專家葉祖光在會中,以《中藥保健食品研發(fā)的動態(tài)》為主題,根據(jù)《食品安全法》、《保健食品注冊辦法》、《CFDA補(bǔ)充規(guī)定及技術(shù)要求有關(guān)指導(dǎo)原則》方面展開深入講解。
新的注冊管理辦法當(dāng)中明確規(guī)定,自發(fā)放《審評意見通知書》電子審評意見后5個工作日開始計時,注冊申請人應(yīng)在3個月內(nèi)一次提交補(bǔ)充材料,逾期則將面臨退審,另一方面注冊相關(guān)費用也明顯提高,申報難度及監(jiān)管審評力度加大,目前普遍要求做兩個標(biāo)志性成分,標(biāo)志性成分需要和功能密切相關(guān)。
葉祖光教授提到大部分原料提取物沒有行業(yè)標(biāo)準(zhǔn)或國家標(biāo)準(zhǔn),常見出現(xiàn)的問題包括(生產(chǎn)工藝不清、得率不準(zhǔn)確、使用禁用加工助劑(如二氯甲烷)、使用禁用的原料或部位、添加標(biāo)志性物質(zhì)純品、隱瞞實際的工藝、同一提取物不同企業(yè)質(zhì)量要求差別大),推薦各企業(yè)使用中醫(yī)經(jīng)典方進(jìn)行配伍,中西合璧,珠聯(lián)璧合。例如骨密度:鈣、氨糖等,抗氧化、美容:葡萄籽、VE。免疫:納豆加靈芝等。

北京中醫(yī)藥大學(xué)教授,國家食藥監(jiān)總局保健食品審評專家張貴君在會中,以《保健食品中藥配方原則和產(chǎn)品研發(fā)的相關(guān)問題》為主題展開深入講解,其中提到中醫(yī)藥要繼續(xù)發(fā)展下去,必須回到兩千年前,從傳統(tǒng)的中醫(yī)藥理論和臨床實踐中尋找答案。
張貴君教授對相關(guān)企業(yè)提出不能強(qiáng)行將某種認(rèn)為有創(chuàng)新性但沒有食用習(xí)慣和保健功能的物質(zhì)作為某種保健食品研制開發(fā),合成原料慎用、少用,或不用。同時中藥作為原料沒有兒童的劑量,應(yīng)該引起高度重視!少年兒童應(yīng)該要有專用的保健食品,1~3歲嬰幼兒不提倡用保健食品。
原輔料的選擇依據(jù)方面,注意參考文獻(xiàn)要達(dá)到要求的數(shù)量(每個原料每項內(nèi)容3~5篇文獻(xiàn))合理性:要按照中醫(yī)藥理論論述并有實踐性參考文獻(xiàn),尤其是申報兩個功能的注意兩個功能的相關(guān)性論述。保健食品的原料必須是已知的食品原料,不可標(biāo)新立異。

原食藥總局保健食品審評中心主任,現(xiàn)中國保健協(xié)會副理事長黃建生在會中,以《保健食品注冊與備案管理辦法》為主題展開深入講解,從辦法的法律依據(jù)、備案管理及注冊管理主要涉及內(nèi)容進(jìn)行探討。
黃建生提到辦法對保健食品等特殊食品實行嚴(yán)格監(jiān)督管理,將保健食品產(chǎn)品上市的管理模式由原來的單一注冊制調(diào)整為注冊與備案相結(jié)合的分類管理模式。并提出總局和省級局管理的權(quán)限。
保健食品許可分類分級管理表


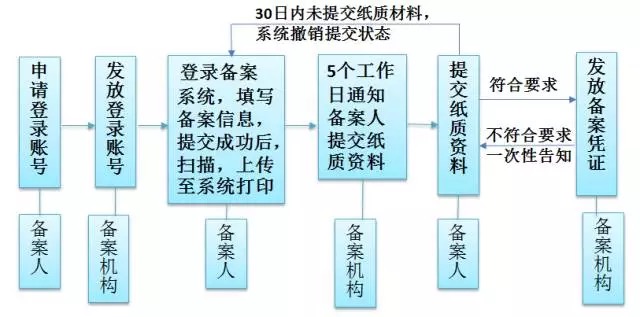
備案產(chǎn)品基本要求應(yīng)使用已經(jīng)列入保健食品原料目錄,保健功能已經(jīng)列入保健食品功能目錄,國產(chǎn)和進(jìn)口產(chǎn)品都需要10多項材料,備案材料符合要求的,當(dāng)場備案;不符合要求的,應(yīng)當(dāng)一次告知備案人補(bǔ)正相關(guān)材料,備案程序與注冊程序相比,簡單了很多,備案管理要對產(chǎn)品配方、原輔料名稱及用量、功效、生產(chǎn)工藝等要求制定詳細(xì)統(tǒng)一的規(guī)定,以適應(yīng)省級食藥局要求,備案工作實施后將會產(chǎn)生很多需要解決的問題。
《備案細(xì)則》的備案流程圖

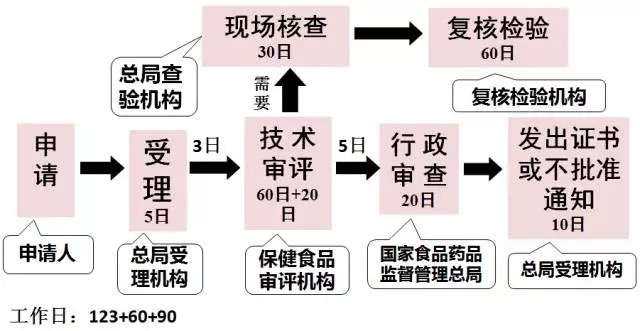
注冊程序方面優(yōu)化了保健食品注冊程序,以受理為注冊審批起點,將現(xiàn)場核查和復(fù)核檢驗調(diào)至審評環(huán)節(jié),由審評機(jī)構(gòu)統(tǒng)一組織現(xiàn)場核查和復(fù)核檢驗,使各項流程緊密銜接,補(bǔ)充資料方面,應(yīng)當(dāng)一次告知需要補(bǔ)正的全部內(nèi)容。注冊制度最重要的改革是技術(shù)審評結(jié)論由專家委員會做出,變?yōu)榱擞蓪徳u中心作出,注冊難度較以往難度增大很多。
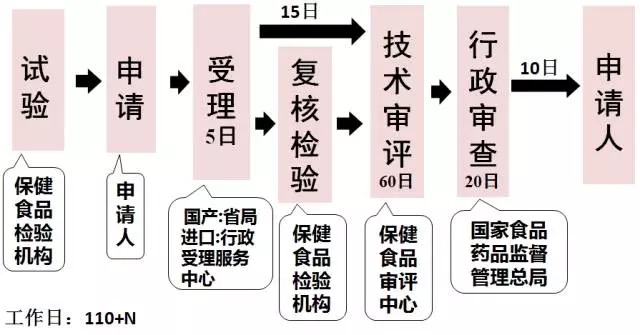
原注冊程序

2016年7月1日執(zhí)行的注冊程序



東南大學(xué)公共衛(wèi)生學(xué)院教授,國家食藥監(jiān)總局保健食品審評專家孫桂菊在會中分別從《新政下保健食品功能學(xué)檢驗與評價》及《保健食品毒理學(xué)評價試驗常見問題》展開講解,深入探討新政下保健食品功能評價試驗及毒理學(xué)評價試驗。
孫桂菊教授講到安全性和保健功能評價試驗應(yīng)送往國家指定的檢驗機(jī)構(gòu)檢驗,對送檢的保健食品進(jìn)行的以驗證保健功能為目的的試驗,包括動物試驗和人群食用評價試驗,出具相應(yīng)的檢驗報告。
以普通食品、衛(wèi)計委規(guī)定的藥食同源物質(zhì)、衛(wèi)計委批準(zhǔn)的新食品原料為原料生產(chǎn)的,無需進(jìn)行毒性試驗的保健食品,服用量與常規(guī)用量相同需做急性毒性、三項致突變試驗,服用量大于常規(guī)用量的,還需加做30天喂養(yǎng)試驗,必要時進(jìn)行傳統(tǒng)致畸試驗和第三階段毒性試驗。由于實驗操作不規(guī)范,根據(jù)提供的檢驗報告無法評價產(chǎn)品的安全性,需要做除30天/90天喂養(yǎng)試驗以外的毒理學(xué)試驗。